
A3:科技智慧
饮用水分配系统是确保城市和乡村地区供水安全的重要组成部分。然而,水源在水厂经过消毒和净化处理,水在进入分配系统并最终到达消费者水龙头的过程中,微生物污染依然是一个不容忽视的问题。随着社会经济发展与居民健康意识的提升,公众对饮用水质量的期待已从基础性的“有水可饮”转向更高标准的“优质好水”。与此同时,城市供水系统的复杂化导致单一水源供水逐渐转向多水源混合供水模式。这种多水源联合调度模式虽然有效保障了水量供给,但不同水源水质的动态混合在管网中形成了混合供水区。与单一水源供水区相比,混合供水区的水质混合更复杂,水力条件剧烈波动,余氯衰减加速,进一步加剧了水质的不稳定性。这种变化重构了微生物群落结构,使混合供水区成为管网水质风险防控的薄弱环节。
饮用水分配系统中的微生物群落主要存在于4个相态:水相、管壁生物膜、悬浮固体和松散沉积物。浮游菌群在水体物质循环中发挥重要作用,其群落主要来源于管壁生物膜和悬浮颗粒。尽管其在水流中的浓度较低,但仍在分配系统中广泛传播和扩散;而悬浮颗粒物相关菌群在水流中通过管道运输,包含大量细菌和颗粒物质,尤其是在水流动态较为复杂的区域,细菌群落常伴随颗粒物质传播。现有水质监测体系存在双重局限,传统化学指标[余氯、电导率(EC)]难以捕捉微生物风险,常规微生物检测(如异养菌总数)缺乏群落功能解析能力。当前研究多将管网微生物视为均质群体,忽视其赋存状态(浮游态或颗粒结合态)的生态学意义,导致微生物风险识别存在盲区。
北京市作为超大型城市,其供水系统依托多水源与多水厂协同运行,形成了复杂交错的管网格局。本研究结合北京市多水源供水系统特性,分析不同点位的水质理化参数及微生物群落,探讨混合供水对浮游态和颗粒结合态微生物多样性及群落结构的影响。研究成果将填补多水源管网微生物相态研究的空白,并为超大城市供水管网的水质管理及微生物风险防控提供科学依据。
1 试验材料和方法
1.1 采样与样品处理
选择北京市三大主力水厂供水管网混合供水区,设置6个典型采样点(图1)。D1为水厂C与水厂A混合供水;D2为水厂A与水厂B混合供水;D5为水厂C与水厂B混合供水;D3、D4、D6为多水源混合供水(含3个水厂)。2024年7月进行系统性采样,为保障微生物样品的代表性与可比性,所有采样点均采用标准化流程。现场放水至水温稳定后进行样品收集,每个点位采集3组平行样品,立即分装储存至无菌容器。同时采集50mL水样用于EC、余氯、浑浊度、NH4+等水质分析。样品于4℃冷链运输至实验室,24h内完成前处理,提取脱氧核糖核酸(DNA)后-80℃保存。
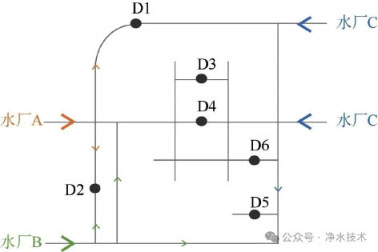
图1 饮用水分配系统混合供水区采样点
1.2 水质分析
常规理化指标包括测定采样点的EC、余氯、浑浊度、NH4+等关键水质指标。余氯利用哈希DR300余氯测定仪测定;EC利用哈希HQ4300多通道电化学测试仪测定;浑浊度利用哈希2100Q便携式浊度仪测定;NH4+通过流动注射仪进行分析,所有分析均进行2次(n=2)。
三磷酸腺苷(ATP) 含量分析采用GloMax®Navigator微孔板发光计(Promega,美国)和Water-GloTM检测试剂(Promega,美国)。试验过程中,将200μL水样与800μLWater-GloTM裂解试剂混合于无菌离心管内,在室温下孵育2h。孵育结束后,每个样品取125μL于96孔板中,测定3次以确保重复性。标准曲线在每次测量前重新绘制,以校正日间测量误差并确保R2值始终大于0.99。最终,根据标准曲线计算各样品的ATP浓度。
1.3 16S rRNA 基因测序
通过0.22μm聚碳酸酯膜与1.2μm混合纤维素酯膜分级过滤水样。根据制造商说明,使用FastDNA土壤离心试剂盒(Q-Biogene/MP Biomedicals,Solon,OH,美国)提取所有样品的DNA。提取后的DNA样品送至美吉生物进行16S rRNA 基因扩增子测序。细菌16S rRNA 基因V3~V4区的扩增采用引物341F(5′-CCTACGGGNGGCWGCAG-3′)和785R (5′-GACTACHVGGGTATCTAATCC-3′),并在IlluminaNovaseq平台(Illumina,美国)上进行300bp双端测序。
测序数据的处理首先使用cutadapt 3.1去除原始序列中的引物,并按照figaro v1.1.2设定的参数修剪序列。质量控制和序列处理采用DADA2 v1.21.0,包括质量过滤、错误率学习、样本推断、冗余序列去除、配对读长合并、扩增子序列变体(ASV)表构建以及嵌合体去除,最终获得ASV表。基于SILVA 138.1 数据库的分类学注释和系统发育重建通过QIIME2 2020.11完成。
1.4 数据分析方法
所有生物信息学分析均在R语言(4.0.0 版本)中进行,主要使用Phyloseq软件包处理和分析微生物群落数据,并利用Ggplot2进行数据可视化。Alpha多样性采用Chao1指数和Observed ASV指数进行计算,Beta多样性分析基于加权和非加权UniFrac距离的主坐标分析(PCoA)。此外,在属水平上统计各样本的群落组成。
2 结果和讨论
2.1 混合供水区水质理化参数
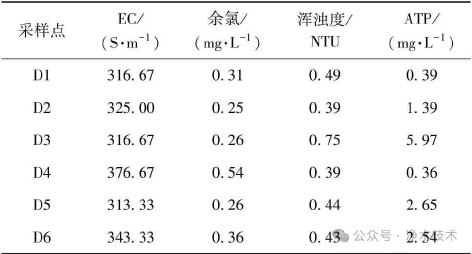
混合供水区受不同水源水质差异及管网水力扰动影响,各点位水质参数表现出一定的不均衡性(表1)。EC在313.33~376.67S/m,其中D4最高;余氯质量浓度为0.25~0.54mg/L,D4最高,D2最低,该差异可能受消毒剂在输配过程中的衰减速率、加氯点距离及水力停留时间等因素影响,同时也可能与水力扰动引发的局部扩散不均有关。浑浊度总体较低(0.39~0.75NTU),D3最高,可能因水力扰动导致颗粒物再悬浮。ATP质量浓度为0.36~5.97mg/L,在D3点位最高,反映该处微生物活性较强。总体而言,余氯、浑浊度和ATP浓度波动较大,表明混合供水及水力扰动可能影响水质稳定性。
表1 混合供水区水质理化参数
为了进一步探讨水质波动对微生物群落结构的潜在影响,分别选取水相和颗粒结合态微生物群落中相对丰度前15的ASV,结合EC、余氯、浑浊度与ATP浓度等水质指标进行Spearman相关性分析(图2)。结果显示,浮游微生物群落中有3个ASV与水质指标呈显著相关(p<0.05),颗粒结合态中则有4个ASV达到显著相关性水平(p<0.05)。相比之下,颗粒态群落的相关性更为突出,ASV12在水相中与EC显著负相关(p<0.05),但在颗粒结合相中呈现极其显著相关性(p<0.001),该类群可能对水质波动更为敏感。
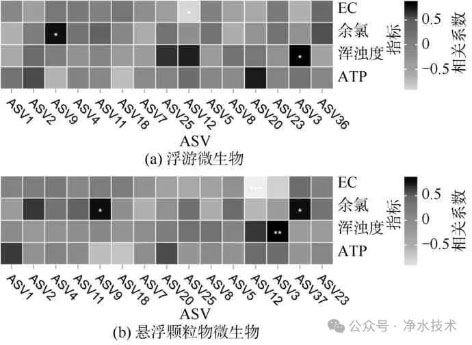
图2 优势微生物ASVs与水质指标的相关性分析
注:颜色表示相关系数,星号表示显著性水平;*表示p<0.05,**表示p<0.01,***表示p< 0.001。
2.2 微生物群落多样性分析
微生物群落的Alpha多样性指数反映了不同相态微生物的物种丰富度与均匀性特征。Observed ASV与Chao1指数分析表明,比起浮游微生物群落,悬浮颗粒物相关微生物的物种丰富度呈现略微升高趋势(图3)。这可能与管网环境中颗粒物在与微生物之间的相互作用有关。颗粒物表面微环境利于微生物生存,微生物黏附在颗粒表面,促使细胞外聚合物(EPS)的分泌和生物膜的形成,从而增加了潜在物种的检出概率。值得注意的是,尽管颗粒结合态群落的Alpha多样性略高于浮游态,但未达到显著水平(Observed ASV中p= 0.355;Chao1中p=0.062)。这与以往的研究中饮用水分配系统里浮游态和悬浮颗粒物相关的微生物群落显著不同的结论不一致。已有研究发现,在未氯化的饮用水分配系统中,悬浮颗粒物相关微生物群落在组成上更接近于管壁生物膜微生物,与浮游态微生物群落在物种组成和多样性方面存在显著差异。然而,本研究的供水系统经过氯消毒处理,浮游微生物更容易受到氯的灭活作用,而颗粒物作为保护屏障,为附着微生物提供了相对稳定的生存环境,减少了消毒剂的直接杀灭效应。因此,颗粒结合态微生物群落在氯化供水系统中占据主导地位,从而削弱了浮游态和颗粒结合态群落之间的差异,进一步导致两相群落的Alpha多样性趋同。
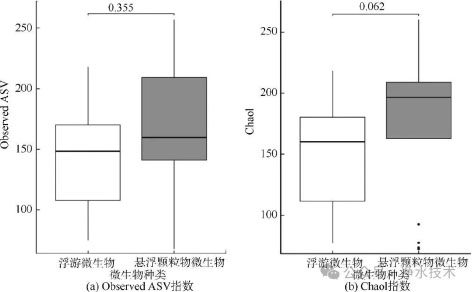
图3 浮游微生物与悬浮颗粒物相关微生物的Alpha多样性比较
基于非加权与加权UniFrac距离的Beta多样性分析表明,北京市混合供水区浮游态与颗粒结合态微生物群落在群落结构及空间分异规律上存在差异。
非加权UniFrac分析显示,浮游微生物群落在系统发育关系上呈现显著的组间分异。D1与D2的群落结构较为相似,而D3和D5的样品间距离较小,这可能缘于二水混合与三水混合后不同的管网水力条件和水质均匀性。值得注意的是,D6的群落结构与上述两类区域均存在明显差异,可能与其复杂的水质动态及管网拓扑结构导致的微生物迁移限制相关。加权UniFrac分析进一步显示,D3~D6样品在高丰度菌群主导下呈现聚类趋同,而D1和D2仍维持显著差异,这种差异可能与管径大小有关。D3~D6均为400~600mm的小管径,而D1和D2为1600mm的主干管,管径通过调控水力条件影响混合供水区的微生物群落结构塑造。
颗粒结合态群落的非加权UniFrac分析显示更高的空间离散度。D1和D4的群落显著偏离其他样品,其他采样点虽呈现部分聚类趋势,但其分布范围大于浮游态群落。这种分异模式可能与颗粒物的吸附差异相关。水厂A、B、C作为3个独立的水厂,它们的原水均不相同,因此,出厂水中包含的颗粒物的组分和含量存在差异,会影响其对微生物的吸附能力,颗粒物的存在增强了混合水源差异对微生物群落的影响,使不同空间采样点的微生物在颗粒表面富集的情况有所不同。加权UniFrac分析表明,D3~D6样品在考虑低丰度菌群时的相似性显著提升,而D1和D2仍维持独立分布。
对比两类群落的Beta多样性特征,微生物群落的分异主要受不同采样点混合供水差异的影响,与各点位的复杂混合供水引起的理化性质波动及ATP浓度差异有关,而非其在管网中的赋存相态。与之前结论相同,D3~D6的群落结构趋同性受高丰度菌群驱动。
2.3 微生物群落组成分析
属水平群落分析揭示了浮游态和颗粒结合态微生物群落的组成特征。在浮游微生物群落(图4)中,微生物群落主要有Phreatobacter spp.、产卟啉杆菌(Porphyrobacter spp.)、DSSF69 spp.、Candidatus-Obscuribacter spp.、罗尔斯通氏菌(Ralstonia spp.)等组成,其中占比最高的是Phreatobacter spp.,在D2~D6中均占主导地位。而D1和D2中Ralstonia spp.的异常增殖解释了Beta多样性分析中D1和D2的持续分异。值得注意的是,Ralstonia spp.是一类适应低营养环境的革兰氏阴性菌,常检出于供水系统中,具备一定的耐消毒性和生物膜形成能力。虽非常规水源病原体,其在饮用水系统中的富集仍可能构成潜在生物安全风险。因此,D1和D2点位中该属菌的显著增殖现象应引起关注。
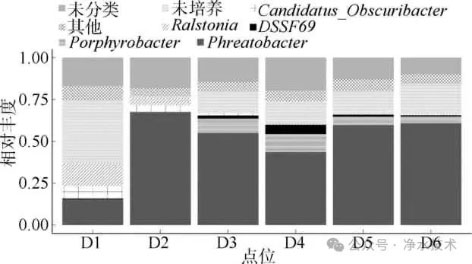
图4 属水平浮游微生物的群落组成
相比之下,悬浮颗粒物相关微生物群落(图5)呈现出不同的组成特征,微生物群落主要有Phreatobacter spp.、Porphyrobacter spp.、Candidatus-Obscuribacter spp.、Ralstonia spp.等组成,其中占比最高的是Phreatobacter spp.。浮游态特征菌DSSF69 spp.在颗粒相中相对丰度减少,表明其对自由水体环境的特异性适应。相比浮游态群落,颗粒结合态群落“other”类群占比增加(相对丰度<0.05),进一步印证颗粒物的存在及其吸附行为差异会影响低丰度物种。两相中均存在相对丰度不低的未培养菌群相对丰度,意味着该水体中存在一些特殊的微生物生态位,这也说明了管网水质不稳定可能带来潜在的生物安全风险。
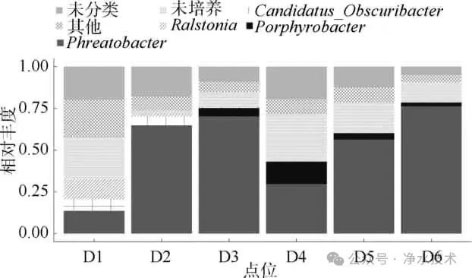
图5 属水平悬浮颗粒物相关微生物群落组成
3 结论
(1)混合供水区水质参数存在一定波动,水质参数(EC、余氯、浑浊度、ATP 浓度)在不同点位存在波动,反映水质的不稳定性,这种波动进一步塑造了微生物群落特征。相关性分析表明,部分高丰度ASV与水质参数呈显著关联(p<0.05),颗粒结合态微生物对水质波动的响应更为敏感。
(2)颗粒结合态群落的物种丰富度略高于浮游态,但两者Alpha多样性差异不显著,可能是由于氯消毒削弱了两相群落的多样性差异,颗粒物提供了微生物稳定的生存环境,使其在氯化系统中占据主导。Beta多样性分析显示,群落分异主要受混合供水引起的水质波动和ATP浓度变化驱动,而非赋存相态。
(3)浮游态与颗粒结合态微生物群落在组成上存在差异,颗粒物影响低丰度菌群分布。Ralstonia?spp.在D1、D2异常增殖加剧群落分异,未培养菌群的存在表明水质不稳定可能带来潜在的生物安全风险。
(4)基于上述特征,建议在混合供水区域加强重点点位的水质监测,特别是对余氯、浑浊度与ATP等敏感指标的动态跟踪,并结合颗粒物管理和水力扰动调控,提升微生物群落变化的识别能力,为供水系统的运行管理提供支持。
(来源:《净水技术》2025年第7期“水源与饮用水保障”)



